
2024년 노벨 화학상 수상자들: 미국 워싱턴 대학교의 데이비드 베이커/David Baker 교수
영국의 딥마인드의 CEO 데미스 하사비스/Demis Hassabis
그리고 역시 딥마인드의 수석 연구원 존 점퍼/John M. Jumper
2024년 노벨 화학상은
딥마인드/Deepmind의 CEO이자 창립자인
데미스 하사비스/Demis Hassabis와
수석 연구원 존 점퍼/John Jumper
그리고 계산 생물학자인 데이비드 베이커/David Baker
교수에게 수여되었다.
하사비스와 점퍼는 AI를 사용해서
지금까지 알려진 단백질 구조를 예측했으며,
베이커 박사는 계산적인 방법으로 단백질 구조를 예측할 뿐 아니라
새로운 단백질을 설계하는 방법을 개발한 공로로
올해 영광의 노벨 화학상 수상자로 선정되었다고
노벨상 위원회가 밝혔다.
단백질은 생물이 필요한 모든 화학 작용을 장관 하는 물질이다.
체내의 호르몬, 면역체, 조직 세포의 형성을 하는 물질들이
단백질로 이루어졌다.

베이커 박사가 개발한 다양한 단백질 구조들
단백질은 20개의 다른 아미노산들이 서로 연결되어서
기다란 끈으로 이루져서 3차원적으로 접힌(folding) 구조를 띄고 있다.
이 구조와 화학 성분은 단백질이 어떻게 상호작용을 일으킬지 결정한다.
1970년대부터 과학자들은 단백질을 이루는 화학적 서열 정보로
단백질의 3차원 구조를 예측하는 연구가 진행되었지만
워낙 난해도가 높아서 이렇다 할 만한 성과가 없었다.
그러다가 2020년에 하사비스와 점퍼는 '알파폴드2/AlphaFold 2'라는
AI 모델을 개발하는 데 성공했다.
알파폴드2 모델 덕분에 2억 개의 달하는
거의 모든 단백질 구조를 예측을 할 수 있게 되었다.
이 모델이 개발된 후 190 국가에서 2천만 명의 사람들이
이 모델을 사용해서 항생제의 내성,
플라스틱 물질을 분해하는 효소의 개발 등
인체의 웰빙과 환경 보호 등 다양한 용도로 사용했으며,
앞으로도 더 빠른 속도로 인류와 환경에 도움이 되는
연구에 새로운 장을 열게 되었다.

Figure 1. A protein can consist of everything from tens of amino acids to several thousand.
The string of amino acids folds into a three-dimensional structure
that is decisive for the protein’s function.
단백질은 수 십 개에서 수 만개의 아미노산/Amino Acids으로 이루어졌다.(왼편 그림)
이 아미노산 띠/String of Amoino Acids는 복잡하게
서로 얽히고 접혀서 3차원 구조를 띄게 되며,
이 구조가 바로 그 단백질의 기능과 역할을 결정한다.
Johan Jarnestad/The Royal Swedish Academy of Sciences
알파폴드2는 과연 어떻게 단백질 구조를 밝혀낼까?
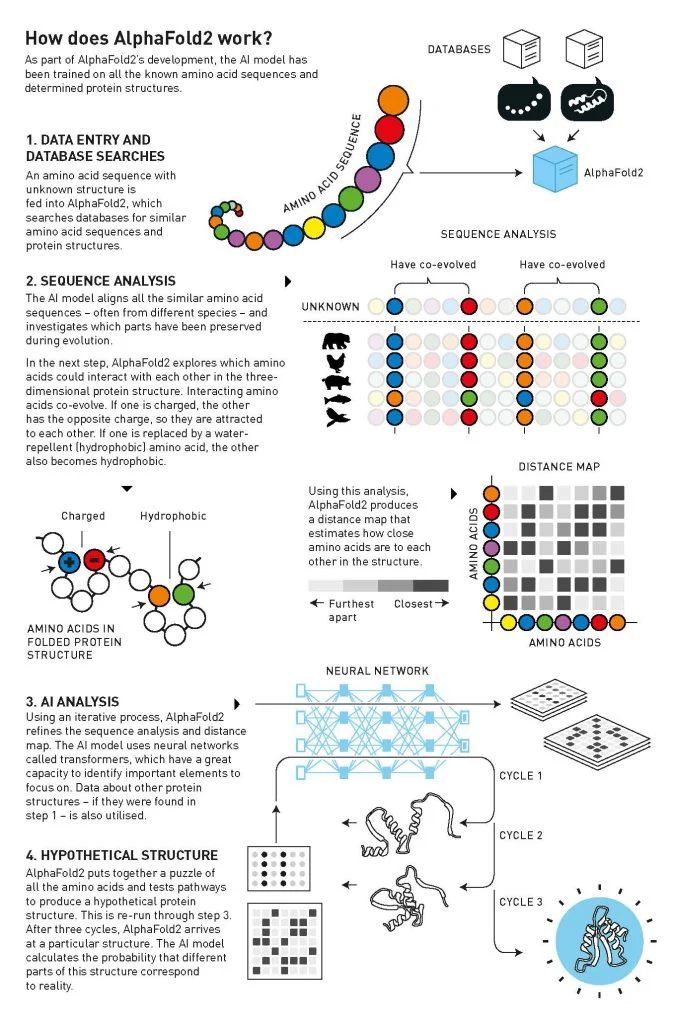
Figure 2. How does AlphaFold2 work?
Johan Jarnestad/The Royal Swedish Academy of Sciences
알파폴드2 AI 모델은 컴퓨터에 입력된
지금까지 밝혀낸 모든 아미노산의 서열을 토대로
3차원적 단백질 구조를 예측한다.
1. 데이터 입력과 검색
단백질 구조가 알려지지 않은 아미노산 서열을
알파폴드2에 입력하면,
알파폴드는 보유하고 있는 데이터베이스에서
비슷한 아미노산 서열과 구조를 검색한다.
2. 아미노산 서열 분석/Sequence Analysis
AI 모델은 다양한 종류의 개체들의 아미노산을 포함한
지금까지 알려진 모든 아미노산 서열들을 정렬시킨 후
어떤 부분이 진화 과정에서 여전히 변하지 않은 부분을 찾는다.
그런 다음에, 알파폴드2는 3차원 단백질 구조 내에서
어떤 아미노산이 서로 반응하는지 살펴본다.
서로 반응을 보이는 아미노산들은 상호적으로 진화한다.
한 특정 아미노산이 실효전하(chared)를 가지면,
다른 아미노산은 그 반대의 실효전하를 띄어 서로 끌어당기게 된다.
한 예로, 소수성/hydrophobic 아미노산이 대체되면,
다른 아미노산도 역시 소수성을 띄게 된다.
3. AI 분석
알파폴드2는 서열 검색과 아미노산 사이의 거리를 측정하는
거리 지도/Distance Map를 개선한다.
이 작업을 위해서 AI는 '트랜스포머'라고 불리는
신경네트워크를 사용해서 단백질 구조를 밝히는
중요한 부분에 포커스를 맞춘다.
4. 가상의 단백질 구조
알파폴드2는 모든 아미노산들의 경로를 테스트해서
가상의 단백질 구조를 만들어낸다.
이를 위해서 위의 3 과정을 반복한 후
특정 단백질 구조가 나오면,
AI 모델이 이 구조의 부분들이 실제의 구조와
어떻게 상화작용을 하는가에 대한 확률을 계산한다.
Figure 3. Top7 – the first protein that was entirely different to all known existing proteins.
알파폴드2가 처음 밝혀낸 단백질 구조
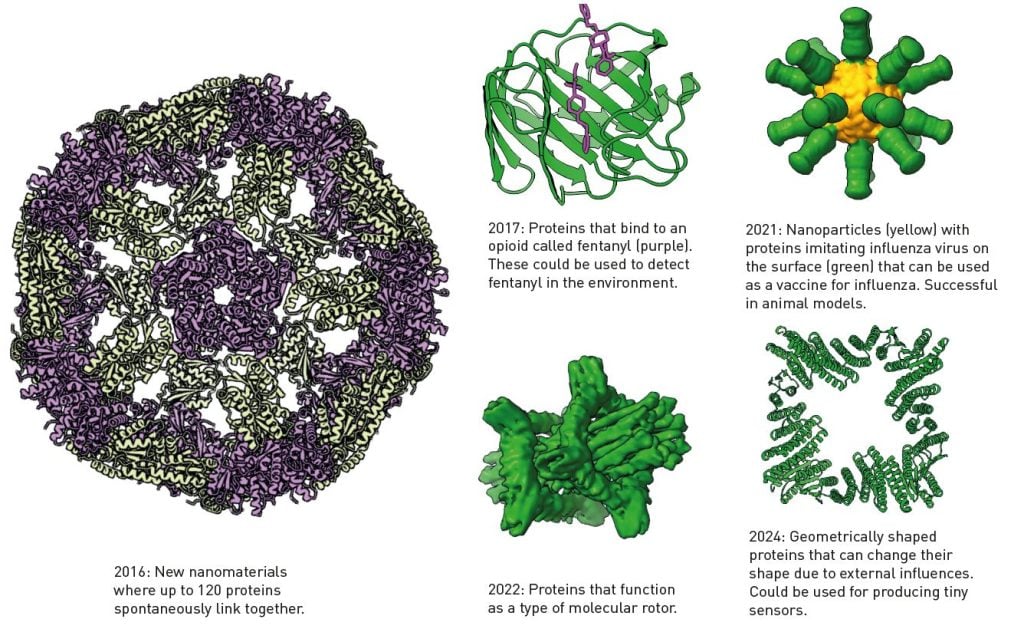
Figure 4. Proteins developed using Baker’s program Rosetta.
베이커 박사가 개발한 로제타로 밝혀낸 단백질 구조들:
Terezia Kovalova/The Royal Swedish Academy of Sciences
( 왼쪽부터) 2016년에 최대 120개의 단백질들이 서로 연결해서 만들어진 극세물질 구조
2017년에 개발한 펜타널 마약(보라색)과 결합하는 단백질을 개발해서
환경에 펜타널 존재를 파악할 수 있게 되었다.
2021년에 개발된 이 나노물질(노란색)은 독감 백신으로 사용되었다.
2022년에 개발된 이 단백질 구조는 분자 회전기이다
2024년에 개발한 이 단백질 구조는 아주 작은 센서로 사용할 수 있는 가능성을 보였다.
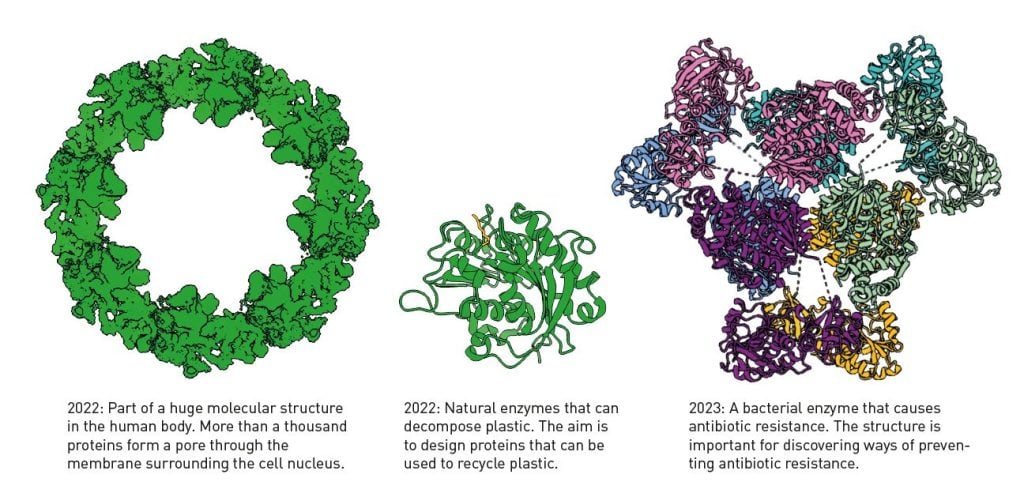
Figure 5. 알파폴드2가 밝혀낸 단백질 구조:
Protein structures determined using AlphaFold2.
왼쪽부터: 1,000여 개의 단백질이 모여 거대한 분자가
세포 핵막을 통과할 수 있는 작은 구멍을 이루고 있다.
2022년에 밝혀낸 이 단백질 구조는
플라스틱 물질을 분해해서 재활용할 수 있는 자연적인 효소이다.
2023년에 밝혀낸 이 박테리아의 효소는
항생제에 대한 내성을 일으키는데,
이 내성을 막아주는 새로운 항생제 개발 연구에 큰 도움이 된다.



